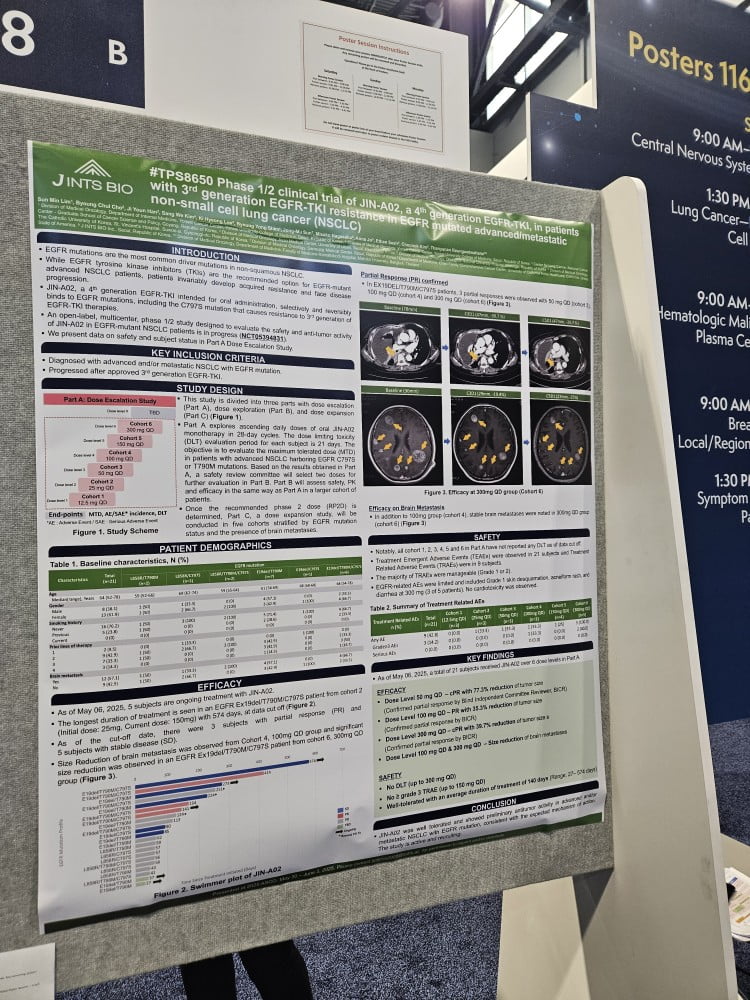
“‘JIN-A02’과 병용요법에 대한 글로벌 제약사들의 관심을 체감할 수 있었습니다.”
지난 31일(현지시간) 미국 시카고에서 개최된 미국임상종양학회(ASCO)에서 만난 김춘옥 제이인츠바이오 연구부문 사장은 이같이 말했다. 제이인츠바이오는 ASCO에서 JIN-A02의 연구 성과를 담은 포스터 발표를 진행했다. 특히 JIN-A02는 올해 ASCO에 참가한 유일한 4세대 EGFR 티로신 키나제 억제제(TKI) 약물이다.
그는 “KRAS, BRAF, MET 등 신약 파이프라인을 보유하고 있는 곳은 EGFR-TKI와 병용에 관심이 높다”며 “JIN-A02가 EGFR-TKI 폐암 치료제 개발에서 병용 전략의 중심축(backbone) 역할을 할 수 있기 때문”이라고 했다.
JIN-A02는 경구용 4세대 EGFR-TKI다. 현재 EGFR 돌연변이 비소세포폐암의 1차 치료제로 쓰이는 3세대 EGFR-TKI 치료 후 발생하는 내성 돌연변이(C797S 등)에 선택적으로 작용한다. 현재 한국과 미국, 태국 등 다국가에서 임상 1상을 진행 중이다.
ASCO 발표는 다기관 임상시험(NCT05394831)의 Part A(용량 증량 시험) 결과를 중심으로 구성됐으며, 주요 유효성과 안전성 결과를 담았다. ASCO에서 주목받은 핵심 성과는 특정 용량군에서 종양이 지속적으로 부분관해(PR)를 확인했다는 점이다. 약물의 항암 활성이 일시적인 반응을 넘어 일정 기간 동안 유지된 임상적 증거로 해석된다.
그는 “JIN-A02는 50mg부터 항암 반응이 관찰됐고, 300mg까지도 심각한 부작용 없이 용량 증량이 가능했다”며 “피부 발진과 설사 등 대부분의 이상반응이 1~2등급의 경미한 수준에 그쳤으며, 고용량에서도 안전성을 확보했다는 점은 병용요법 확대에 유리한 조건”이라고 강조했다.
특히 100mg 및 300mg 용량군에서 뇌전이 병변의 실질적인 반응을 유도한 사례가 관찰됐다. 이는 약물이 뇌조직 내에도 일정 농도로 도달할 수 있음을 시사하며, 향후 임상 2상에서 뇌전이 환자를 별도 코호트로 설정해 보다 정밀한 분석이 이뤄질 수 있는 근거로 작용한다.
김 사장은 “현재 1상 마무리 단계로, 연내 미국을 포함한 글로벌 2상에 본격 진입할 계획”이라고 덧붙였다. 기존 EGFR-TKI의 내성 문제를 해결할 수 있는 차세대 약물로서 입지를 굳히겠다는 목표다.
시카고=김유림 기자 youforest@hankyung.com

 1 month ago
13
1 month ago
13
!["1번 출구에서 톡 주세요"…휴대폰 성지 '쩐의 전쟁' 시작? [현장+]](https://img.hankyung.com/photo/202507/ZN.41189477.1.jpg)





![[월드스마트시티엑스포]인터콘시스템스-전력·철도차량 제어시스템](https://img.etnews.com/news/article/2025/07/17/news-p.v1.20250717.160fb9810e49473c874cf869a01068e9_P2.jpg)
![[기고]서울대 10개 만들기, 간판만 바꿔선 안 된다](http://thumb.mt.co.kr/21/2025/06/2025062210141793003_1.jpg)
![[팔면봉] 李 대통령, 나토 회의 불참. 외](https://it.peoplentools.com/site/assets/img/broken.gif)
![[프로야구 창원전적] NC 10-9 두산](https://r.yna.co.kr/global/home/v01/img/yonhapnews_logo_1200x800_kr01.jpg?v=20230824_1025)




 English (US) ·
English (US) ·