
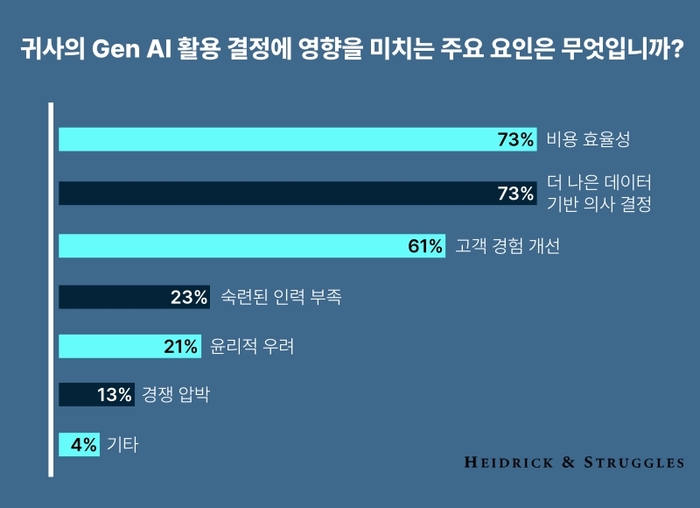
의약품 제조 및 품질관리기준(GMP)은 우수한 의약품을 안전하게 생산·공급하기 위한 기본 체계다. 국내 제약사는 의약품을 제조하거나 품목허가를 받기 위해 반드시 GMP 적합판정을 받아야 하며, 이를 유지하지 못하면 생산 자체가 불가능해진다. 문제는 2022년 이후 도입된 GMP 적합판정 취소제도가 그 기준과 집행 방식에서 여러 법적·제도적 혼선을 야기하고 있다는 점이다.
특히 “반복적인 기록 위반”이 적발될 경우, 식약처가 기존에 부여한 GMP 적합판정을 취소할 수 있도록 규정하고 있으나, ‘반복적 위반’의 의미, ‘적용 단위’, ‘위반 정도’의 구체적 판단 기준은 법령상 매우 모호하다. 이런 불명확성은 실무 집행 과정에서 자의적인 해석을 가능케 하고, 불균형한 제재로 이어질 우려가 크다.
적합판정 단위는 ‘품목’, 관리 단위는 ‘제형’
약사법 제38조의3은 GMP 적합판정 취소의 대상이 “해당 의약품 등”임을 명시하고 있다. 여기서 ‘해당 의약품’은 제조소 전체나 제형군이 아닌 개별 품목을 의미한다. 실제 GMP 관련 문서 대부분은 품목별로 작성된다. 제조지시서, 제조기록서, 품질관리기준서 등은 모두 품목 단위로 구분되어야 하며, 공정 밸리데이션 및 시험방법도 품목별로 독립적으로 적용된다.
반면 실무에서는 GMP 심사의 효율성을 이유로 ‘제형’ 단위로 묶어 관리하는 경우가 많다. 이는 행정 편의를 위한 조치일 뿐, 위반 행위가 발생했을 때도 제형 단위로 일괄 GMP 적합판정을 취소해야 한다는 근거는 되지 않는다. 관리 단위와 책임 단위의 혼동은 현장에서 기업에 과도한 불이익을 초래할 수 있다.
‘원 스트라이크 아웃제’는 법에 없다
식약처는 반복적 GMP 위반이 확인되면 최초 적발시에도 시정명령 없이 즉시 적합판정을 취소하는 이른바 ‘원 스트라이크 아웃제’를 도입하여 적용하고 있다. 그러나 이 제도는 법률이나 시행령 어디에도 명시되어 있지 않다. GMP 제도는 본래 의약품의 품질을 확보하고 문제를 예방하기 위한 시스템이지, 기업을 퇴출하기 위한 징벌적 제도가 아니다.
국제적으로도 미국, 일본, EU 등은 GMP 위반이 발생하는 경우 단계적 조치—예컨대 경고, 시정명령, 보완명령 등을 거친 뒤에야 제한적 제재를 가하는 방식이 일반적이다. 첫 위반만으로 생산을 전면 중단하는 조치는 비례의 원칙은 물론 국제 기준에도 부합하지 않는다.

경미한 위반에 중대한 처분이 가능해지는 구조
GMP 적합판정 취소제도의 또 다른 문제는 위반행위의 중대성과 실제 위해 여부를 불문하고 동일한 수준의 처분이 가능하다는 점이다. 예컨대 첨가제 용량의 경미한 변경, 기록상의 기재 오류 등 비교적 경미한 사안조차도 반복성이 인정되면 곧바로 해당 품목이 속하는 제형 전체에 대한 적합판정 취소로 이어질 수 있다.
이는 법령의 불명확성과 기준의 부재에서 비롯된 구조적 문제다. 결과적으로 정작 위반행위가 발생하지 않았고 위해성도 입증되지 않은 품목까지도 동일한 수준의 제재를 받게 되고, 이는 제약사의 생산 차질은 물론, 의료현장의 의약품 공급에도 심각한 영향을 미친다.
행정의 효율성과 법적 정당성의 충돌
GMP 적합판정 확인·조사는 행정 효율을 위해 일부 제형에서 대표 품목만 샘플로 심사받는 방식으로 운영되지만, 규범적으로는 심사가 생략된 품목에 대한 적합판정도 개별적으로 존재한다. 따라서 GMP 위반이 발생한 경우, 개별 품목별로 위반 여부를 가려 해당 품목에 대해 제재 처분을 하는 것이 타당하다.
그럼에도 현재는 제형에 속하는 일부 품목에 관한 GMP 위반을, 해당 품목이 속하는 제형 전체에 대한 GMP 위반으로 간주하거나, 확인되지 않은 위해 가능성을 근거로 제형군 전체를 제재하는 방식이 이어지고 있다. 이는 행정 효율성과 법적 정당성의 균형이 무너진 전형적인 사례라 할 수 있다.

개선 방향: 단계적, 비례적, 명확한 제도 운영
GMP 적합판정 취소제도의 제도적 신뢰성과 산업 수용성을 확보하기 위해서는 다음의 3가지 개선 방향이 필요하다. 먼저, 취소 대상은 반드시 ‘품목 단위’로 명확히 해야 한다. 행정상 편의를 위한 제형 단위 심사와 제재 단위는 엄격히 구분되어야 한다. 위반행위에 따른 처분은 단계적이어야 한다. 위반 정도와 위해 가능성에 따라 시정명령 → 개선확인 → 적합판정 취소로 이어지는 절차가 법령에 명시되어야 한다. ‘반복적 위반’의 개념과 판단 기준을 구체화해야 한다. 동일 품목 내 반복인지, 여러 품목에 걸친 동일 유형 위반인지, 위반 기간과 경중은 어떠한지 등에 대한 기준이 없으면 자의적 판단 가능성이 높아진다.
GMP는 징벌이 아니라 품질을 위한 약속
GMP는 제약사의 품질관리 능력을 인증하는 제도이지, 위법행위를 징계하기 위한 수단이 아니다. 오히려 품질의 확보와 개선을 유도하는 방향으로 운영되어야 한다. 법적 불확실성과 규제 남용이 지속될 경우, 국내 제약산업의 지속가능한 발전은 물론 글로벌 신뢰 확보에도 장애가 될 수 있다.
‘신뢰’는 GMP의 핵심 가치이며, 그 신뢰는 규제 당국의 예측 가능하고 공정한 제도 운영에서 비롯된다. 법과 제도의 본질이 산업의 생존을 좌우하는 도구가 되어서는 안 된다. GMP 적합판정 취소제도 역시 이제, 정교한 기준과 합리적 절제 위에 다시 자리매김해야 할 때다.
!["법엔 없는 원스트라이크 아웃 근거"…의약품 적합판정 취소, 이대로 괜찮나?[화우의 바이오헬스 인사이트]](https://img.hankyung.com/photo/202506/01.40652859.1.jpg)
권동주 법무법인 화우 변호사 | 대법원 지식재산권조 재판연구관, 서울 고등법원 고법판사, 특허법원 제1호 고법판사를 역임했다. 오랜 재판실무경험을 통해 법적 분쟁의 공격방어에서 의뢰인의 이익을 법률적으로 확실하게 뒷받침하여 승소를 이끌어내고 있다. 메디톡스를 대리하여 17전 16승의 전무후무한 실적을 거두는 등 국내 지식재산권 및 바이오헬스분야에서 활약하고 있다.

 4 hours ago
1
4 hours ago
1














 English (US) ·
English (US) ·