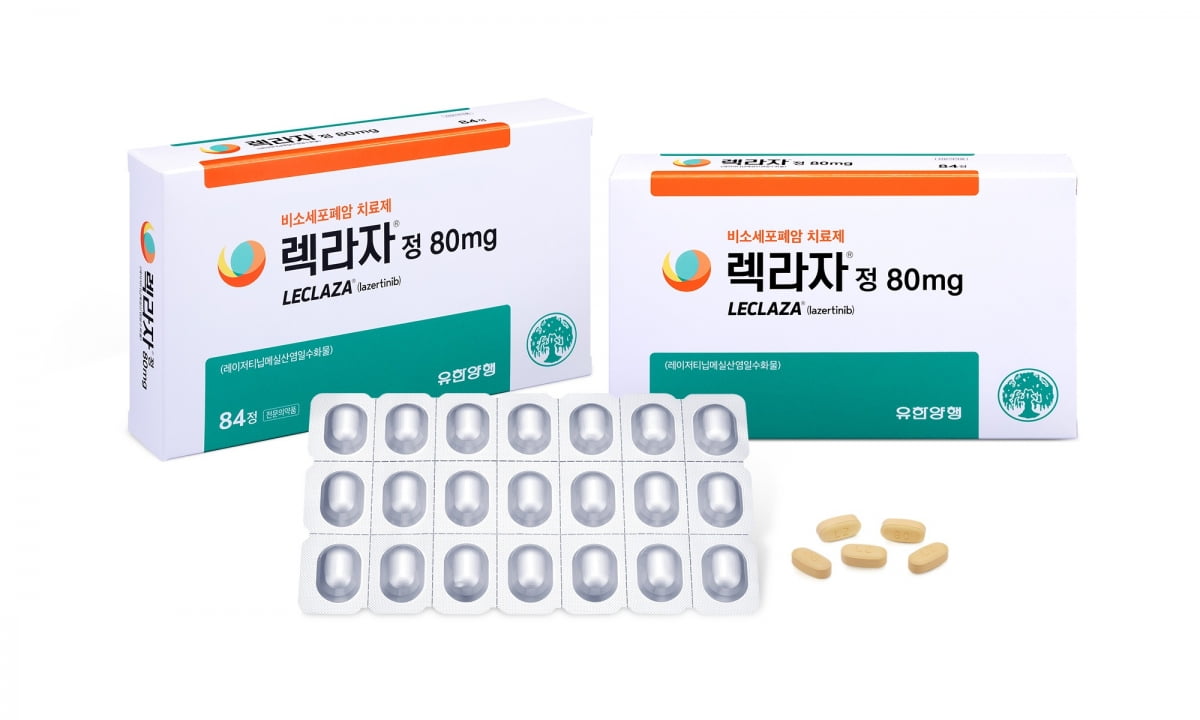
유한양행의 렉라자가 미국 유럽에 이어 영국에서도 시판 허가를 받았다. 경쟁 제품인 아스트라제네카 타그리소의 '종주국' 영국에서도 규제 장벽을 넘으면서 시장성을 다시 한번 입증했다는 평가다.
영국 의약품허가청(MHRA)은 6일(현지시간) 라즈클루즈(성분명 레이저티닙)를 상피성장인자수용체(EGFR) 변이 비소세포폐암 치료제로 승인했다고 발표했다. 라즈클루즈는 렉라자의 미국과 유럽 상품명이다. 라즈클루즈를 아미반타맙과 함께 사용하도록 허가했다.

MHRA는 라즈클루즈를 쓰면 EGFR을 차단해 폐암 성장을 늦추거나 멈추는 데 도움될 수 있다고 설명했다. 매일 복용하면 암 크기를 줄이는 데에도 도움된다고 밝혔다.
MHRA는 비소세포폐암 환자 1074명이 참여한 임상 3상시험(마리포사) 데이터를 토대로 허가를 결정했다. 세 그룹으로 나눠 한 그룹은 라즈클루즈와 아미반타맙 병용 요법을, 또다른 그룹은 라즈클루즈 단독요법을, 다른 그룹은 영국 아스트라제네카 타그리소를 투여하도록 한 뒤 효과를 비교하는 방식으로 진행했다.
해당 임상시험에서 라즈클루즈와 아미반타맙 병용 치료를 받은 환자는 다른 치료를 받은 환자보다 무진행생존기간(PFS)이 길었다고 MHRA는 설명했다. 줄리안 비치 MHRA 의료품질 책임자는 "라즈클루즈가 신규 약물 승인을 위한 안전성, 품질 등의 규제 기준에 충족했다"며 "성인 폐암 환자를 위한 새 치료제를 승인하게 돼 기쁘다"고 했다.
영국은 규제장벽이 상대적으로 높은 것으로 꼽히는 데다 경쟁약인 타그리소의 종주국이다. 업계 관계자는 "당초 예상보다 영국 허가가 상당히 빠르게 나왔다"며 "폐암 환자 치료 공백을 메우는 데 렉라자 병용요법이 활용 가치가 높다는 의미"라고 했다.
이지현 기자 bluesky@hankyung.com

 1 week ago
4
1 week ago
4





![인공장기 손상없이 정밀측정→간질환 신약 만든다 [지금은 과학]](https://image.inews24.com/v1/fb373a870b685e.jpg)






 English (US) ·
English (US) ·